Authors: Jeanne S Sheffield, MD, Suresh B Boppana, MD
Section Editors: Louise Wilkins-Haug, MD, PhD, Martin S Hirsch, MD
Deputy Editor: Vanessa A Barss, MD, FACOG
Contributor Disclosures
All topics are updated as new evidence becomes available and our peer review process is complete.
Literature review current through: Feb 2020. | This topic last updated: Mar 05, 2020.
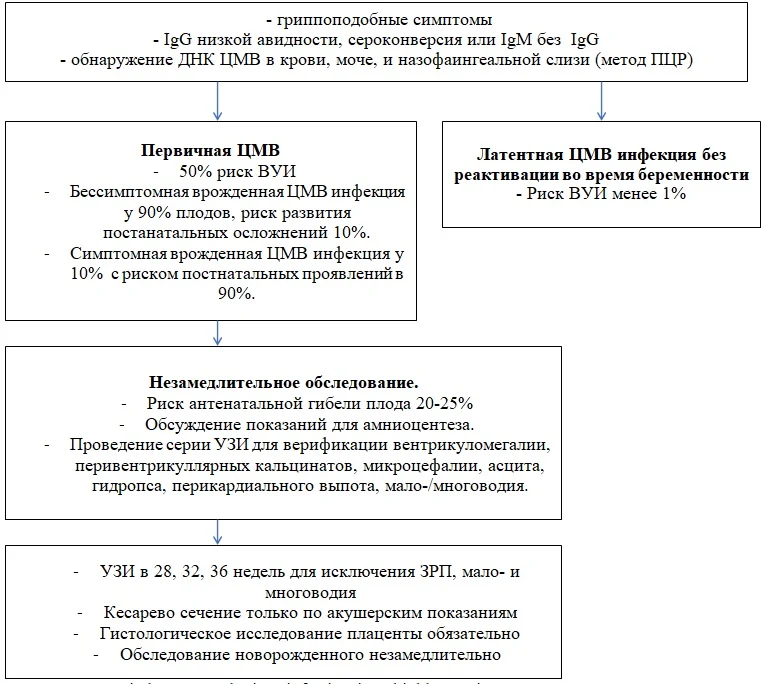
Цитомегаловирус – представитель семейства герпесвирусов, вызывающий широко распространенную в популяции, латентно протекающую инфекцию. Около 40-80% населения серопозитивны к ЦМВ в результате перенесенного контакта. У взрослых серонегативных людей заболевание может возникнуть только в случае иммунодефицита (ВИЧ, химиотерапия, кортикостероиды более 3 мес.). После первичного контакта вирус цитомегалии сохраняется в организме пожизненно. Во время беременности возможна его реактивация в 2-2.5%. При первичном инфицировании во время беременности риск ВУИ составляет 30-40%, но в большинстве случаев протекает бессимптомно. Только в 20-25% случаев ВУИ заболевание реализуется у новорожденного постнатально.
При вторичной инфекции в период беременности (реактивация латентно – персистирующей ЦМВ инфекции или инфицирование новым штаммом вируса серопозитивной женщины) риск инфицирования плода не превышает 2 - 4%.
В группу риска по ЦМВ инфицированию включены:
Клиническая картина. Симптомы ЦМВ инфекции неспецифичны и включают усталость, слабость, увеличение лимфатических узлов, диарею, катаральные явления, болезненные изъязвления на слизистых, одышку, мышечные и суставные боли, субфебрильную лихорадку. Симптомы могут сохраняться на протяжении нескольких недель.
У лиц с ослабленным иммунитетом ЦМВ инфекция может протекать тяжело, вызывая развитие гепатита, миокардита, энцефалита.
Как и при других герпесвирусных инфекциях, после перенесенного активного заболевания вирус не элиминируется, а персистирует в лимфатических узлах. В следствие угнетения иммунной системы происходит частая реактивация вируса, сопровождающаяся появлением в крови специфических IgМ. Вирус может выявляться во всех жидкостях организма.
Врожденная ЦМВ инфекция встречается с частотой 0.3-0.6% и связана с инфицированием в любом триместре беременности. Наиболее тяжелые случаи с поражением ЦНС развиваются при заражении в период зачатия, в первом или в начале второго триместра. Инфицирование в первой половине беременности ассоциируется с развитием ЗРП, микроцефалии и кальцификатов в головном мозге плода. Инфицирование в более поздние сроки ассоциировано с кожными поражениями, пневмонией, гепатитом, пурпурой и тромбоцитопенией. При заболевании в период зачатия риск инфицирования эмбриона составляет 0.2-2%. Инфицирование плода может произойти трансплацентарно и контактно (интранатально, постнатально).
Не абсолютными, но возможными ультразвуковыми признаками реализации внутриутробной инфекции у плода являются:
У 10% новорожденных с врожденной ЦМВ проявляются симптомы заболевания (желтуха, гепатоспленомегалия, кожная сыпь, микроцефалия, маловесность, хориоретинит, гемолитическая анемия, тромбоцитопения), еще у 10% - на момент рождения никаких признаков болезни нет, но в последующие 5 лет может развиться сенсорно-невральная глухота, нарушение зрения, координаций движения, аутизм, эпилепсия. Первичная ЦМВ инфекция является самостоятельной причиной антенатальной гибели плода.
Проявлениями симптомной врожденной ЦМВ инфекции является:
При МРТ головного мозга у 70% новорожденных с клиническими проявлениями врожденной ЦМВ инфекции выявляется:
Диагностика первичной ЦМВ инфекции затруднена в связи с тем, что до 90% ее протекает бессимптомно. Обнаружение специфических IgM или их конверсии в IgG у изначально серонегативных пациенток свидетельствует об инфекции. При этом титр антител не имеет значения. При обнаружении IgG должна быть подтверждена их низкая авидность. Определение только IgM не имеет смысла, так как антитела появляются и в случае реактивации латентной инфекции, и при повторном контакте. Диагноз вторичной ЦМВ инфекции основан на подтверждении значительного увеличения титра IgG высокой авидности.
Диагноз ВУИ может быть подтвержден при амниоцентезе (исследование амниотической жидкости) после 21 недели беременности.
Новорожденные подлежат наблюдению в случае подтверждения у матери первичной ЦМВ. Плацента направляется на гистологическое и вирусологическое исследование. У новорожденных проводится забор крови (не из умбиликальных сосудов) для определения титра IgM.
ЦМВ проникает в грудное молоко, но преимущества от грудного вскармливания многократно превышают риски инфицирования для плода. Отказ от грудного вскармливания оправдан только в группе глубоко недоношенных плодов, когда их иммунная система не в состоянии справиться с возбудителем.
Лечение ЦМВ во время беременности проводится только у иммуноскомпрометированных пациенток или при развитии симптомного течения инфекции (пневмония). Ацикловир 10-15 мг в/в капельно 3 раза в день 10 дней, иммуноглобулин в/в 25 мл в/в капельно. Цитотект – 2 мл/кг каждые 2 дня минимум 6 доз, для профилактики 1 мл/кг Фоскарнет - противовирусный препарат, в/в 40 мг/кг каждые 8 часов 14-21 день. Цидофовир – 5 мг/кг в/в капельно на 100 мл физиологического раствора 1 раз в 2 недели 2 раза
Профилактика первичной ЦМВ инфекции включает:
Схема. Скрининг на ЦМВ-инфекцию
При вторичной инфекции в период беременности (реактивация латентно – персистирующей ЦМВ инфекции или инфицирование новым штаммом вируса серопозитивной женщины) риск инфицирования плода не превышает 2 - 4%.
В группу риска по ЦМВ инфицированию включены:
- Женщины из социально неблагоприятной среды (только 50-60% серопозитивны).
- Женщины из развивающихся стран.
- Женщины в возрасте 25-30 лет.
- Многорожавшие пациентки.
- Женщины с детьми до 3-х лет, посещающих детский сад.
- Наличие у матери АТ к ЦМВ не исключает риск реактивации и репликации вируса.
Клиническая картина. Симптомы ЦМВ инфекции неспецифичны и включают усталость, слабость, увеличение лимфатических узлов, диарею, катаральные явления, болезненные изъязвления на слизистых, одышку, мышечные и суставные боли, субфебрильную лихорадку. Симптомы могут сохраняться на протяжении нескольких недель.
У лиц с ослабленным иммунитетом ЦМВ инфекция может протекать тяжело, вызывая развитие гепатита, миокардита, энцефалита.
Как и при других герпесвирусных инфекциях, после перенесенного активного заболевания вирус не элиминируется, а персистирует в лимфатических узлах. В следствие угнетения иммунной системы происходит частая реактивация вируса, сопровождающаяся появлением в крови специфических IgМ. Вирус может выявляться во всех жидкостях организма.
Врожденная ЦМВ инфекция встречается с частотой 0.3-0.6% и связана с инфицированием в любом триместре беременности. Наиболее тяжелые случаи с поражением ЦНС развиваются при заражении в период зачатия, в первом или в начале второго триместра. Инфицирование в первой половине беременности ассоциируется с развитием ЗРП, микроцефалии и кальцификатов в головном мозге плода. Инфицирование в более поздние сроки ассоциировано с кожными поражениями, пневмонией, гепатитом, пурпурой и тромбоцитопенией. При заболевании в период зачатия риск инфицирования эмбриона составляет 0.2-2%. Инфицирование плода может произойти трансплацентарно и контактно (интранатально, постнатально).
Не абсолютными, но возможными ультразвуковыми признаками реализации внутриутробной инфекции у плода являются:
- Перивентрикуллярная кальцификация
- Вентрикуломегалия
- Микроцефалия
- Гиперэхогенный кишечник
- ЗРП
- Гепатоспленомегалия
- Полимикрогирия
- Гипоплазия мозжечка
- Псевдокисты перивентрикулярные или примыкающие к затылочной или височной долям
- Перивентрикулярная гиперэхогенность
- Увеличение большой цистерны
- Многоводие
- Асцит или плевральный выпот
- Гидропс плода
- Утолщение плаценты
У 10% новорожденных с врожденной ЦМВ проявляются симптомы заболевания (желтуха, гепатоспленомегалия, кожная сыпь, микроцефалия, маловесность, хориоретинит, гемолитическая анемия, тромбоцитопения), еще у 10% - на момент рождения никаких признаков болезни нет, но в последующие 5 лет может развиться сенсорно-невральная глухота, нарушение зрения, координаций движения, аутизм, эпилепсия. Первичная ЦМВ инфекция является самостоятельной причиной антенатальной гибели плода.
Проявлениями симптомной врожденной ЦМВ инфекции является:
- Петехиальная сыпь 54-76%
- Желтуха при рождении 38-67%
- Гепатоспленомегалия 39-60%
- Гипотрофия 36-53%
- Микроцефалия 36-53%
- Сенсорное снижение слуха 34%
- Сонливость и/или гипотония 27%
- Слабое сосание 19%
- Хориоретинит 11-14%
- Судороги 4-11%
- Гемолитическая анемия 11%
- Пневмония 8%
При МРТ головного мозга у 70% новорожденных с клиническими проявлениями врожденной ЦМВ инфекции выявляется:
- Перивентикуллярная кальцификация - 34-70%
- Васкулопатия - 27-68%
- Поражение белого вещества головного мозга - 22-57%
- Вентрикуломегалия -10-53%
- Мальформация коры головного мозга (полимикрогирия, пахигирия, лесэнцефалия) - 10-38%
- Перивентрикуллярная лейкомаляция и кистозные аномалии - 11%
Диагностика первичной ЦМВ инфекции затруднена в связи с тем, что до 90% ее протекает бессимптомно. Обнаружение специфических IgM или их конверсии в IgG у изначально серонегативных пациенток свидетельствует об инфекции. При этом титр антител не имеет значения. При обнаружении IgG должна быть подтверждена их низкая авидность. Определение только IgM не имеет смысла, так как антитела появляются и в случае реактивации латентной инфекции, и при повторном контакте. Диагноз вторичной ЦМВ инфекции основан на подтверждении значительного увеличения титра IgG высокой авидности.
Диагноз ВУИ может быть подтвержден при амниоцентезе (исследование амниотической жидкости) после 21 недели беременности.
Новорожденные подлежат наблюдению в случае подтверждения у матери первичной ЦМВ. Плацента направляется на гистологическое и вирусологическое исследование. У новорожденных проводится забор крови (не из умбиликальных сосудов) для определения титра IgM.
ЦМВ проникает в грудное молоко, но преимущества от грудного вскармливания многократно превышают риски инфицирования для плода. Отказ от грудного вскармливания оправдан только в группе глубоко недоношенных плодов, когда их иммунная система не в состоянии справиться с возбудителем.
Лечение ЦМВ во время беременности проводится только у иммуноскомпрометированных пациенток или при развитии симптомного течения инфекции (пневмония). Ацикловир 10-15 мг в/в капельно 3 раза в день 10 дней, иммуноглобулин в/в 25 мл в/в капельно. Цитотект – 2 мл/кг каждые 2 дня минимум 6 доз, для профилактики 1 мл/кг Фоскарнет - противовирусный препарат, в/в 40 мг/кг каждые 8 часов 14-21 день. Цидофовир – 5 мг/кг в/в капельно на 100 мл физиологического раствора 1 раз в 2 недели 2 раза
Профилактика первичной ЦМВ инфекции включает:
- Соблюдение личной гигиены, мытье рук в течение 15-20 секунд (особенно после контакта с биологическими жидкостями)
- Избегать поцелуев в губы или щеки детей до 6 лет
- Использовать раздельные столовые приборы, не допивать и не доедать за детьми. Использовать личную зубную щетку
- Мыть все предметы и игрушки, которые контактируют со слюной или мочой ребенка
Схема. Скрининг на ЦМВ-инфекцию
Схема. Ведение пациенток с ЦМВ инфекцией
Литература:
1. Mussi-Pinhata MM, Yamamoto AY, Moura Brito RM, et al. Birth prevalence and natural history of congenital cytomegalovirus infection in a highly seroimmune population. Clin Infect Dis 2009; 49:522.
2. Davis NL, King CC, Kourtis AP. Cytomegalovirus infection in pregnancy. Birth Defects Res 2017; 109:336.
3. Hyde TB, Schmid DS, Cannon MJ. Cytomegalovirus seroconversion rates and risk factors: implications for congenital CMV. Rev Med Virol 2010; 20:311.
4. Mussi-Pinhata MM, Yamamoto AY, Aragon DC, et al. Seroconversion for Cytomegalovirus Infection During Pregnancy and Fetal Infection in a Highly Seropositive Population: "The BraCHS Study". J Infect Dis 2018; 218:1200.
5. Center for Disease Control. Knowledge and Practices of Obstetricians and Gynecologists Regarding Cytomegalovirus Infection During Pregnancy - United States, 2007 https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5703a2.htm (Accessed on October 21, 2016).
6. Leruez-Ville M, Sellier Y, Salomon LJ, et al. Prediction of fetal infection in cases with cytomegalovirus immunoglobulin M in the first trimester of pregnancy: a retrospective cohort. Clin Infect Dis 2013; 56:1428.
7. Kanengisser-Pines B, Hazan Y, Pines G, Appelman Z. High cytomegalovirus IgG avidity is a reliable indicator of past infection in patients with positive IgM detected during the first trimester of pregnancy. J Perinat Med 2009; 37:15.
8. Revello MG, Genini E, Gorini G, et al. Comparative evaluation of eight commercial human cytomegalovirus IgG avidity assays. J Clin Virol 2010; 48:255.
9. Enders G, Daiminger A, Bäder U, et al. The value of CMV IgG avidity and immunoblot for timing the onset of primary CMV infection in pregnancy. J Clin Virol 2013; 56:102.
10. Prince HE, Lapé-Nixon M. Role of cytomegalovirus (CMV) IgG avidity testing in diagnosing primary CMV infection during pregnancy. Clin Vaccine Immunol 2014; 21:1377.
11. Wang C, Zhang X, Bialek S, Cannon MJ. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection. Clin Infect Dis 2011; 52:e11.
12. Society for Maternal-Fetal Medicine (SMFM), Hughes BL, Gyamfi-Bannerman C. Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol 2016; 214:B5.
13. Picone O, Grangeot-Keros L, Senat M, et al. Cytomegalovirus non-primary infection during pregnancy. Can serology help with diagnosis? J Matern Fetal Neonatal Med 2017; 30:224.
14. Barbosa NG, Yamamoto AY, Duarte G, et al. Cytomegalovirus Shedding in Seropositive Pregnant Women From a High-Seroprevalence Population: The Brazilian Cytomegalovirus Hearing and Maternal Secondary Infection Study. Clin Infect Dis 2018; 67:743.
15. Picone O, Vauloup-Fellous C, Cordier AG, et al. A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome. Prenat Diagn 2013; 33:751.
16. Gabrielli L, Bonasoni MP, Lazzarotto T, et al. Histological findings in foetuses congenitally infected by cytomegalovirus. J Clin Virol 2009; 46 Suppl 4:S16.
17. Townsend CL, Forsgren M, Ahlfors K, et al. Long-term outcomes of congenital cytomegalovirus infection in Sweden and the United Kingdom. Clin Infect Dis 2013; 56:1232.
18. Ross SA, Novak Z, Pati S, et al. Mixed infection and strain diversity in congenital cytomegalovirus infection. J Infect Dis 2011; 204:1003.
19. Mwaanza N, Chilukutu L, Tembo J, et al. High rates of congenital cytomegalovirus infection linked with maternal HIV infection among neonatal admissions at a large referral center in sub-Saharan Africa. Clin Infect Dis 2014; 58:728.
20. Manicklal S, van Niekerk AM, Kroon SM, et al. Birth prevalence of congenital cytomegalovirus among infants of HIV-infected women on prenatal antiretroviral prophylaxis in South Africa. Clin Infect Dis 2014; 58:1467.
21. Ellington SR, Clarke KE, Kourtis AP. Cytomegalovirus Infection in Human Immunodeficiency Virus (HIV)-Exposed and HIV-Infected Infants: A Systematic Review. J Infect Dis 2016; 213:891.
22. Frederick T, Homans J, Spencer L, et al. The effect of prenatal highly active antiretroviral therapy on the transmission of congenital and perinatal/early postnatal cytomegalovirus among HIV-infected and HIV-exposed infants. Clin Infect Dis 2012; 55:877.
23. Guibert G, Warszawski J, Le Chenadec J, et al. Decreased risk of congenital cytomegalovirus infection in children born to HIV-1-infected mothers in the era of highly active antiretroviral therapy. Clin Infect Dis 2009; 48:1516.
24. Rodrigues S, Gonçalves D, Taipa R, Rodrigues Mdo C. Nonprimary Cytomegalovirus Fetal Infection. Rev Bras Ginecol Obstet 2016; 38:196.
25. Lazzarotto T, Guerra B, Gabrielli L, et al. Update on the prevention, diagnosis and management of cytomegalovirus infection during pregnancy. Clin Microbiol Infect 2011; 17:1285.
26. Manicklal S, Emery VC, Lazzarotto T, et al. The "silent" global burden of congenital cytomegalovirus. Clin Microbiol Rev 2013; 26:86.
27. Enders G, Daiminger A, Bäder U, et al. Intrauterine transmission and clinical outcome of 248 pregnancies with primary cytomegalovirus infection in relation to gestational age. J Clin Virol 2011; 52:244.
28. Pereira L, Petitt M, Fong A, et al. Intrauterine growth restriction caused by underlying congenital cytomegalovirus infection. J Infect Dis 2014; 209:1573.
29. Enders M, Daiminger A, Exler S, et al. Prenatal diagnosis of congenital cytomegalovirus infection in 115 cases: a 5 years' single center experience. Prenat Diagn 2017; 37:389.
30. Revello MG, Furione M, Zavattoni M, et al. Human cytomegalovirus (HCMV) DNAemia in the mother at amniocentesis as a risk factor for iatrogenic HCMV infection of the fetus. J Infect Dis 2008; 197:593.
31. Simonazzi G, Guerra B, Bonasoni P, et al. Fetal cerebral periventricular halo at midgestation: an ultrasound finding suggestive of fetal cytomegalovirus infection. Am J Obstet Gynecol 2010; 202:599.e1.
32. Picone O, Teissier N, Cordier AG, et al. Detailed in utero ultrasound description of 30 cases of congenital cytomegalovirus infection. Prenat Diagn 2014; 34:518.
33. Moore CA, Staples JE, Dobyns WB, et al. Characterizing the Pattern of Anomalies in Congenital Zika Syndrome for Pediatric Clinicians. JAMA Pediatr 2017; 171:288.
34. Lipitz S, Hoffmann C, Feldman B, et al. Value of prenatal ultrasound and magnetic resonance imaging in assessment of congenital primary cytomegalovirus infection. Ultrasound Obstet Gynecol 2010; 36:709.
35. Leyder M, Vorsselmans A, Done E, et al. Primary maternal cytomegalovirus infections: accuracy of fetal ultrasound for predicting sequelae in offspring. Am J Obstet Gynecol 2016; 215:638.e1.
36. Bilavsky E, Yarden-Bilavsky H, Waisman Y, Marcus N. Bilateral primary spontaneous pneumothorax: buffalo chest. Pediatr Emerg Care 2009; 25:33.
37. Leruez-Ville M, Stirnemann J, Sellier Y, et al. Feasibility of predicting the outcome of fetal infection with cytomegalovirus at the time of prenatal diagnosis. Am J Obstet Gynecol 2016; 215:342.e1.
38. Cahill AG, Odibo AO, Stamilio DM, Macones GA. Screening and treating for primary cytomegalovirus infection in pregnancy: where do we stand? A decision-analytic and economic analysis. Am J Obstet Gynecol 2009; 201:466.e1.
39. Walker SP, Palma-Dias R, Wood EM, et al. Cytomegalovirus in pregnancy: to screen or not to screen. BMC Pregnancy Childbirth 2013; 13:96.
40. American College of Obstetricians and Gynecologists. Practice bulletin no. 151: Cytomegalovirus, parvovirus B19, varicella zoster, and toxoplasmosis in pregnancy. Obstet Gynecol 2015; 125:1510. Reaffirmed 2017.
41. Tanimura K, Tairaku S, Morioka I, et al. Universal Screening With Use of Immunoglobulin G Avidity for Congenital Cytomegalovirus Infection. Clin Infect Dis 2017; 65:1652.
42. Revello MG, Tibaldi C, Masuelli G, et al. Prevention of Primary Cytomegalovirus Infection in Pregnancy. EBioMedicine 2015; 2:1205.
43. Revello MG, Zavattoni M, Furione M, et al. Preconceptional primary human cytomegalovirus infection and risk of congenital infection. J Infect Dis 2006; 193:783.
44. Jacquemard F, Yamamoto M, Costa JM, et al. Maternal administration of valaciclovir in symptomatic intrauterine cytomegalovirus infection. BJOG 2007; 114:1113.
45. Leruez-Ville M, Ghout I, Bussières L, et al. In utero treatment of congenital cytomegalovirus infection with valacyclovir in a multicenter, open-label, phase II study. Am J Obstet Gynecol 2016; 215:462.e1.
46. Nigro G, Adler SP, La Torre R, et al. Passive immunization during pregnancy for congenital cytomegalovirus infection. N Engl J Med 2005; 353:1350.
47. Nigro G, Adler SP, Parruti G, et al. Immunoglobulin therapy of fetal cytomegalovirus infection occurring in the first half of pregnancy--a case-control study of the outcome in children. J Infect Dis 2012; 205:215.
48. Visentin S, Manara R, Milanese L, et al. Early primary cytomegalovirus infection in pregnancy: maternal hyperimmunoglobulin therapy improves outcomes among infants at 1 year of age. Clin Infect Dis 2012; 55:497.
49. Revello MG, Lazzarotto T, Guerra B, et al. A randomized trial of hyperimmune globulin to prevent congenital cytomegalovirus. N Engl J Med 2014; 370:1316.